100℃以上の温度でのタンパク質の安定化機構を熱力学的に解明 - 超耐熱化タンパク質の設計が可能に -(プレスリリース)
- 公開日
- 2015年10月26日
2015年10月26日
理化学研究所
日本医療研究開発機構
|
理化学研究所(理研)放射光科学総合研究センター生物試料基盤グループの油谷克英上級研究員、松浦祥悟リサーチアソシエイトらと、高輝度光科学研究センター(JASRI)、大阪大学蛋白質研究所の共同研究グループは、100℃以上の温度領域で生息する超好熱菌[1]などが産生する非常に高い熱安定性を示す超耐熱性タンパク質の熱安定性に寄与する疎水性相互作用[2](疎水性のアミノ酸残基間の相互作用)と静電的相互作用[3](荷電性のアミノ酸残基間の相互作用)の熱力学的な役割を実証的に解明しました。 ※共同研究グループ 原論文情報 |
背景
タンパク質は私たちの体の主な構成成分の一つであります。タンパク質は20種類のアミノ酸が多数連なってできており、個々に特有の姿かたち、立体構造を持っています。この立体構造は、タンパク質が生理機能を発揮するために必須で、アミノ酸の配列によって規定され、熱力学的法則によって安定化しています。このことは、タンパク質の立体構造の壊れやすさや、構造を支えている疎水性相互作用(疎水性のアミノ酸残基間の相互作用)、静電的相互作用(荷電性のアミノ酸残基間の相互作用)などの特徴が、変性の熱力学的パラメータ[5]とその量によって説明できることを示します。したがって、タンパク質の安定化機構の理解には、熱力学的パラメータの温度関数を得ることが重要になります。熱力学的解析を行うには、タンパク質の熱による変性反応が可逆的であることが必要ですが、通常のタンパク質の熱変性は、80℃を超えるとタンパク質が凝集を起こして不可逆となるため、特に100℃を超える温度での熱力学的解析は技術的に困難でした。
タンパク質の安定化には、疎水性相互作用が重要とされています。しかし、100℃以上の高い温度では、「熱力学的視点から見たとき、疎水性相互作用が安定化因子として機能しているのかどうか」という論争があり、これまで実験的に検証されていませんでした。
また、超好熱菌などが産出する超耐熱性タンパク質には荷電性のアミノ酸残基(荷電性残基)が、好熱菌や常温生物などのタンパク質に比べ高い割合で存在することから、安定化に重要な働きをしていると考えられていました。しかし、静電的相互作用が100℃以上の高い温度で熱力学的にどのような役割を担っているか実験的な検討はなされていませんでした。そのため、100℃以上の温度で機能するタンパク質の安定化機構の熱力学的解明は、超好熱菌が発見されて以来待ち望まれていました。
研究手法と成果
研究グループは、2006年に変性温度が約150℃の超耐熱性を持つタンパク質を発見しました。超好熱菌株の一種Pyrococcus horikoshii由来のタンパク質「CutA1」で、非常に多くの荷電性残基が存在することが熱安定化に寄与していると推定しました。CutA1はバクテリアからヒトの脳に至るまで広範囲の生物に存在することが知られています。ただ、その機能は、大腸菌由来のCutA1(図1)では金属イオンとの関わりが議論されているものの、まだよく分かっていません。
αはαへリックス構造、βはβシート構造を示す。色分けされた3つの構造単位から成る三量体である。
共同研究グループは、まず、大腸菌由来のCutA1(=EcCutA1)を構成するアミノ酸のうちシステイン(Cys)をアラニン(Ala)に置換することによって、熱変性反応の可逆性が優れた変異型「EcCutA1_0SH(変性温度86℃)」を作成しました。変異型の熱安定性を示差走査熱量計 (DSC)[6]を用いて測定し、変性の熱力学的パラメータを求めました。図2の黒のカーブは1回目のDSC測定です。赤いカーブは2回目のDSC測定で熱変性直後に冷却して再度昇温し測定した結果です。赤と黒の2つのカーブは完全に重なり、EcCutA1_0SHの熱変性は完全な可逆性を示しています。
黒のカーブは1回目のDSC測定。赤いカーブは2回目の測定で、熱変性直後冷却して再度昇温し測定した。EcCutA1_0SHでは、赤と黒の2つのカーブが完全に重なっていることから可逆性を示していることが分かった。
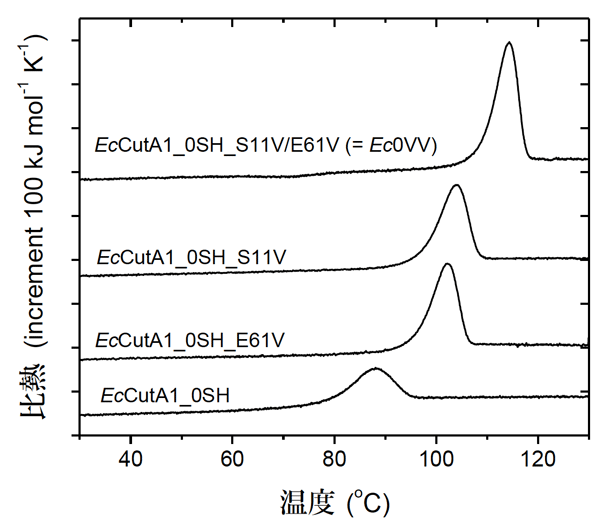
続いてEcCutA1_0SHを鋳型として、セリン(Ser)を疎水性のバリン(Val) で置換した疎水性変異型「EcCutA1_0SH_S11V」と、グルタミン酸(Glu)をバリン(Val)で置換した疎水性変異型「EcCutA1_0SH_E61V」、また、その2重変異型「EcCutA1_0SH_S11V/E61V(=EcOVV)」を作成し、DSC測定を行いました(図3)。DSCカーブから、変性温度 (Td) (5割の分子が変性状態にある温度、DSCカーブのピーク近傍の温度)が求められます。変性温度は、安定性を表す指標です。EcCutA1_0SH(86℃)に対して疎水性変異型の変性温度 (Td)の増加はEcCutA1_0SH_S11Vが17.1℃、EcCutA1_0SH_E61Vが15.4℃となり、2つのアミノ酸を置換したEcOVV は27.6℃となり、2残基の置換で30℃近い熱安定性の改善が見られました。EcCutA1_0SH_S11VとEcOVV の熱変性の可逆性は、図2でみると赤と黒の2つのカーブがほぼ重っており、良好であることが分かります。
図3 EcCutA1_0SHの疎水性変異型のDSCカーブ
2重変異型「EcCutA1_0SH_S11V/E61V(=Ec0VV)」は2つのアミノ酸残基のバリン(Val)置換によって変性温度が27.6℃上昇した。
次に、この2重変異型「EcOVV」を荷電性残基導入の鋳型として用い、種々の荷電性残基を導入して、荷電性残基変異型を作成しました。DSCカーブから変性の熱力学量を精度良く求められる13種の荷電性残基変異型について、変性温度(Td)と変性のエンタルピー変化(ΔH)[5]のデータを図4に示します。最も熱安定性が高くなった変異型の変性温度は136.8℃(=409.8K)で、Ec0VVに新たに6個の荷電性残基を導入した「Ec0VV_A39D/S48K/H72K/S82K/Q87K/T88R(=Ec0VV_6)」でした。この変性温度は、超好熱菌由来のCutA1の値、約150℃に接近するもので、大腸菌由来のCutA1を超好熱菌型CutA1へ変換することに成功したといえます。
荷電性残基変異型の変性温度でのエンタルピー変化(ΔH)をプロットしている。黒と赤のカーブはEc0VV_6のΔHとTΔSの温度関数を示す。
熱変性に伴う比熱変化(ΔCp)[7]は、熱力学的パラメータを得るための基礎となる値です。これまで80℃以下では、ΔCpの温度変化は小さいので一定値を仮定して取り扱われていました。しかし、それより高い温度では、温度依存性を加味しなければならず、現状では温度依存性を考慮した解析は行われていません。100℃以上の温度でタンパク質安定性の熱力学的解析が不可能だった原因は、不可逆変性と確定されないΔCp値にありました。本研究では、高い熱安定性を持つ変異型を用いて、天然(N)状態の比熱(CpN)の温度依存性を、熱変性が始まらない温度領域でのDSC測定によって求めました。Ec0VVでは、95℃、Ec0VV_6では110℃まで実測しました。しかし、変性(D)状態の比熱(CpD)は、可逆性が良いことが災いして、低温でのD状態の測定が困難だったため、アミノ酸組成から類推する方法により求め、熱変性の熱力学的パラメータの温度関数を算出しました。
その結果、100℃付近での疎水性相互作用による熱安定化は、低温領域を対象としたこれまでの報告とは異なり、エンタルピー[5]の寄与に由来していること、さらにエンタルピー[5]的にはむしろ不利に働いていることが判明しました。また、113℃以上では、荷電性残基(塩結合形成)による熱安定化は、天然状態での静電的相互作用によるエンタルピー効果と塩結合形成に伴う荷電残基からの脱水和によるエントロピー効果の両方に依存していることが分かりました。図5にEc0VVとEc0VV_6の広い温度範囲での熱変性の熱力学的パラメータの温度依存性を示します。
青のカーブはエンタルピー変化、赤はエントロピー変化、黒はギブスエネルギー変化を示す温度依存曲線。
今後の期待
本研究で、100℃以上の温度での疎水性相互作用と静電的相互作用の熱力学的役割が明らかになりました。今回の結果を活用し、あらかじめ疎水性変異導入により熱安定性を高めたのち、荷電性変異を導入することによって、100℃以上の熱安定化を必要とするタンパク質の設計が可能となります。壊れにくいタンパク質は、医学・薬学などの分野で取り扱いやすいタンパク質試料として、あるいは工業分野における耐熱素材として必要とされています。今後、実証実験を繰り返す必要がありますが、100℃以上の熱安定性を持つ超耐熱タンパク質の設計に、今回の結果を活用することが期待されます。
補足説明
[1]超好熱菌
80~90℃以上の温度を好んで生育する細菌を超好熱菌と呼ぶ。50~60℃の温度を好んで生育する好熱菌とは区別される。超好熱菌由来のタンパク質は、常温生物、好熱菌由来のタンパク質に比べ、熱安定性が特段に高い。
[2]疎水性相互作用
水分子と親和性の少ない非極性基が水溶液中で互いに集まろうとする相互作用。バリン(Val)、ロイシン(Leu)などの疎水性アミノ酸は非極性基の側鎖を持ちその側鎖どうしがタンパク質分子内部で互いに凝集して疎水性相互作用を形成し、タンパク質安定化に重要な役割を果たしている。
[3]静電的相互作用
静電的相互作用は、塩結合あるいはイオン結合とも呼ばれ、正と負の荷電性のアミノ酸(荷電性残基)間のイオン-イオン相互作用である。5~6オングストローム(Å)程度離れた距離まで相互作用が及ぶといわれている。超好熱菌が産出するタンパク質には荷電性残基が多く含まれ、安定化に重要な役割を果たしていると考えられているが、まだ不明なことが多い。
[4]荷電性残基
側鎖がイオン化したアミノ酸残基を荷電性残基と呼ぶ。イオン化して負荷電をもつアミノ酸残基はアスパラギン酸(Asp)、グルタミン酸(Glu)、イオン化して正電荷をもつアミノ酸残基はアルギニン(Arg)、リシン(Lys)、ヒスチジン(His)。
[5]タンパク質変性の熱力学的パラメータ、エンタルピー変化(ΔH)、エントロピー変化(ΔS)及びギブスエネルギー変化(ΔG)
タンパク質の変性が可逆的であれば、天然状態をN状態、変性状態をD状態とすると、タンパク質の変性は次式で表される。

ここで、Kは平衡定数、[D] と[N]はDとN状態の濃度を示す。そこで、タンパク質の安定性の量的尺度である変性のギブスエネルギー変化(ΔG、正の値が大きいほど安定性が高い)は平衡定数から次式によって求められる。
ΔG = - RT ln K
ここで、Rは気体定数、Tは絶対温度である。
他の熱力学的パラメータ、変性のエンタルピー変化(ΔH)と変性のエントロピー変化(ΔS)は次式で関係づけられる。
ΔG = ΔH - TΔS
ΔGがΔHかΔSのどちらの寄与によって、安定化(正の値の増加)されているかが分かれば、安定化のメカニズムが、本文に示すように説明できる。
なお、ΔHはその反応が吸熱反応か発熱反応であるかを示す。ΔSはその系の秩序性を示し、例えば、結合していた水分子が解放されると、ΔSが増大する。
[6]示差走査熱量計(DSC)
DSCはDifferential Scanning Calorimeterの略。試料セルと参照セルを同時に一定速度で昇温させ、試料の構造変化を熱量の出入りから観測する。タンパク質変性の熱量を直接的に測定できるので、仮定を含まない熱力学量が得られる。
[7]タンパク質変性の比熱変化(ΔCp)
タンパク質は天然(N)状態と変性(D)状態における比熱の差(ΔCp)が大きいことが特徴である。80℃以下ではΔCpの温度依存性は無視できるが、より高い温度ではΔCpの温度関数が他の熱力学的パラメータに大きな変化をもたらす。ΔCpの温度変化を考慮したΔH及びΔSの温度関数は次の式で表される。Tdは変性温度。

|
<<問い合わせ先>> 創薬等ライフサイエンス研究支援基盤事業について: <AMED事業について> <機関窓口> (SPring-8に関すること) |
- 現在の記事
- 100℃以上の温度でのタンパク質の安定化機構を熱力学的に解明 - 超耐熱化タンパク質の設計が可能に -(プレスリリース)