胃酸分泌を担う胃プロトンポンプの構造を解明 ~胃酸抑制剤結合構造と強酸に対してプロトンを吐き出す仕組み~(プレスリリース)
- 公開日
- 2018年04月05日
- BL32XU(理研 ターゲットタンパク)
- BL41XU(構造生物学I)
2018年4月5日
国立大学法人名古屋大学
国立研究開発法人日本医療研究開発機構(AMED)
【ポイント】
• 胃酸抑制剤の結合構造が解明されることで、既存薬剤の改良、および新規薬剤創製への重要な情報が得られました。
• 長い間の謎であった『なぜ胃の中にpH 1もの強酸性環境が作り出せるのか』という疑問に対する重要な発見がなされました。
名古屋大学細胞生理学研究センター(CeSPI)・大学院創薬科学研究科の阿部 一啓 准教授、藤吉 好則 客員教授らの研究グループは、消化にとって重要な胃酸分泌を担う (『酸』を胃の中に汲み出す)胃プロトンポンプの構造を原子分解能で解明することに成功しました(図1)。 【論文情報】 |
消化にとって重要な臓器である胃の表面には、胃酸を分泌する胃プロトンポンプが発現しています。このプロトンポンプが、細胞内のエネルギーを利用してH+(プロトン)を胃の内部へと輸送することで、胃の内部をpH 1という強い酸性環境にしています。これは消化にとって重要ですし、胃潰瘍の原因にもなるので、胃酸抑制剤のターゲットとされています。
背景
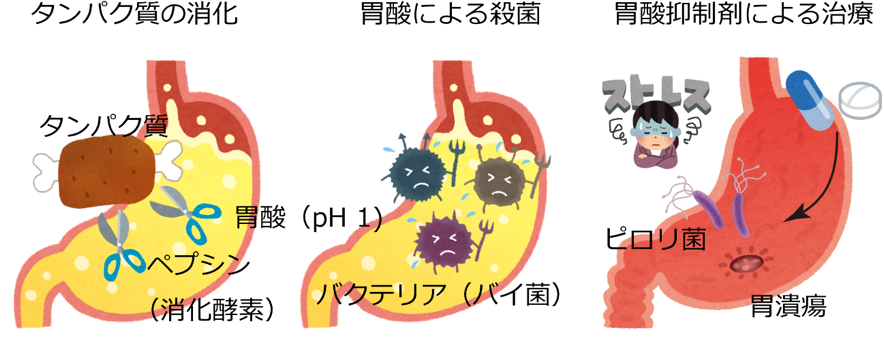
我々が食物を摂取すると、胃酸(塩酸)が分泌され胃の内部はpH(ペーハー) 1という、非常に酸性度の高い状態になります。この強酸性環境(塩酸に換算して0.1 mol/l)は、タンパク質分解酵素であるペプシンの活性化に必要です。また、摂取したタンパク質は強酸性環境によって酸変性し、ペプシンによって分解されやすい形になります。従って、胃酸はタンパク質の消化にとってなくてはならないものです(図2左)。また、胃の内部には摂取した食物が数時間留まりますが、咀嚼嚥下した富栄養物が体温下で滞留しているにもかかわらず、これが腐敗しない理由は、強酸性環境がバクテリアの繁殖を抑えているからにほかなりません(図2中)。このように、『消化』という我々の生命の営みにとって欠くことが出来ない重要な働きを担う胃酸ですが、時としてこの強酸性環境は自身に牙を剥きます。暴飲暴食、様々なストレスなどにより、胃酸と胃粘膜分泌のバランスが崩れると、胃酸は胃本体を傷つけ、不快な胸焼けや、ひどい場合には胃潰瘍といった重篤な症状を呈します。このような症状の治療には、胃酸抑制剤が用いられます(図2右)。
胃酸分泌によって胃の内部が酸性(pH 1)になると、(左)摂取したタンパク質が変性し、消化されやすい形になります。また、タンパク質分解酵素であるペプシンは酸性状態で活性化されます。(中)強い酸性条件では、殆どのバクテリアが生存できません。口を経由して侵入してきたバイ菌たちは、胃酸によって殺菌されます。(右)胃酸によって胃自身が傷つくことで、胃潰瘍になります。この治療に胃酸抑制剤が用いられています。また、ピロリ菌は胃酸の中でも生きられる数少ないバクテリアで、胃潰瘍や胃癌の原因とされていますが、このバクテリアを抗生物質で除菌するときにも、胃酸を抑制する必要があります。
上述した胃内部の強酸性環境を生み出す為に中心的な役割を果たしているのが、胃プロトンポンプと呼ばれる、『酸』(プロトン、H+)を胃の中に汲み出す(ポンプする)タンパク質です(図3)。胃プロトンポンプは、胃の表面、胃壁細胞の細胞膜で働いています。酸性度の高い、つまりH+の濃度が高い(pHの低い)胃の内部に向かってH+を輸送することは、濃度勾配に逆らった輸送なのでエネルギーが必要です(能動輸送)。胃プロトンポンプは、細胞内に存在するATP(アデノシン三リン酸、細胞のエネルギー共通通貨とも言われる)をエネルギー源として、胃の中にH+を輸送し、反対方向にK+(カリウムイオン)を輸送します。このような働きから、別名H+,K+-ATPase(ATPのエネルギーを使ってH+とK+を輸送するタンパク質、という意味)と呼ばれます。細胞の内部が中性(pH 7付近)であることを考えると、胃の内部とのpH差は6ユニットにあたり、これはH+濃度に換算すると106 = 1,000,000倍の差ということになります。細胞膜を隔てたこのような大きなイオン濃度差は、我々の体の他の組織を見渡しても見つからない、非常に大きなものです。なぜ胃プロトンポンプが胃の中にpH 1もの強酸性環境を作り出せるのかという問題は、いまから40年以上前にこの分子が同定されて以来、ずっと未解決の謎でした。
H+,K+-ATPase
研究成果
(1) 胃酸抑制剤結合構造
胃酸分泌の直接的な担い手であるが故に、胃プロトンポンプは胃酸抑制剤のターゲットとされ、この分子の特異的阻害剤は胃潰瘍等の治療に用いられてきました。また、胃癌の原因とされるピロリ菌の除菌は胃酸を抑制した状態で行う必要があり、抗生物質と共に胃酸抑制剤が服用されます(図2右)。最近上市されたvonoprazan(商品名:タケキャブ®錠、武田薬品工業株式会社)という化合物は、高い親和性で対向輸送イオンであるK+と競合的に胃プロトンポンプに結合し、この活性を阻害します。この薬剤は、以前まで主流であったPPI(Proton Pump Inhibitor)とは異なる機序で胃プロトンポンプを阻害する新しいクラスの薬剤で、P-CAB(K+-Competitive Acid Blocker)というクラスに分類されます。P-CABはPPIと比べ迅速に胃酸分泌を抑制し、PPIよりも高い治療効果が期待されています。
今回、研究グループは、ヒト由来の培養細胞によって人工的に胃プロトンポンプを発現させ、ここから大量に調製した胃プロトンポンプを使って3次元結晶を作製し、大型放射光施設SPring-8のX線マイクロフォーカスビーム(BL32XU, BL41XU)を利用して回折データを取得することにより、上述の胃酸抑制剤が結合した結晶構造を原子レベル(2.8 Å分解能)で解明することに成功しました。この結晶構造から、P-CABがどのように胃プロトンポンプに結合し胃酸分泌を阻害するのかが理解できました(図4)。
胃プロトンポンプは、イオン結合サイトから胃の中にH+を送り出し、代わりにK+を取り込みます。図左は、胃プロトンポンプの細胞膜付近の構造を縦に輪切りにしたスライスを示しています。今回の構造では、胃酸抑制剤(vonoprazan, マゼンタで表示)がちょうどイオンの通り道にはまり込むように結合しており、イオンが通過できなくなっていました(中)。結合部位を拡大すると、胃酸抑制剤がタンパク質(アミノ酸を球で表示してある)の窪みにすっぽりとはまり込んでいる様子がわかります(図右)。
胃酸抑制剤は、胃プロトンポンプのイオンの通り道にすっぽりとはまり込み、これをブロックすることで活性を阻害していることが判明しました(図4左)。また、これらの化合物が胃プロトンポンプに対してどの様に結合しているかが原子レベルで判明したことにより(図4右)、構造に基づいた論理的な分子の設計が可能となり、今後、新しい胃酸抑制剤の創製や、既存薬剤の更なる改良が期待されます。
(2)強酸性環境(pH 1)を作り出す仕組みを解明
胃プロトンポンプは、細胞内から膜貫通部位に存在するイオン結合サイトへとH+を取り込み、ATPのエネルギーを使ってこれを細胞外(胃内腔)へと排出することで、胃の内部にH+濃度の高い(pHの低い)状態を作り出します。イオン結合サイトには、複数の酸性アミノ酸(グルタミン酸)が存在しており、これがH+を結合/解離します。しかしながら、グルタミン酸がH+を解離できるのは、せいぜいpH 3~4程度の溶液までであり、胃内部のpH 1という環境にH+を放出することは、通常であれば不可能な反応です。
イオン結合サイトには、2つのグルタミン酸(Glu795, Glu820)と、プラスに帯電したリジン(Lys791)が非常に近接した状態を作り出していました(左)。これによって、Glu820はもはやH+を保持することができなくなり、ちょうどビリヤードのように(右)隣りのGlu795へとH+を離します。Glu795は胃内部の溶液に面しており、ここからH+が1つだけ、pHに関係なく押し出されます。
今回、明らかになった構造は、胃プロトンポンプが、まさに胃の内部にH+を放出した直後の状態を捉えていました(図5左)。H+結合部位では、2つのグルタミン酸が異常に近接した構造になっており、これによって、通常よりもH+を解離しやすい状態を作り出していることがわかりました。さらに、この近接した2つのグルタミン酸に対して、正電荷を帯びたリジンが静電的に相互作用~マイナスの電荷とプラスの電荷が引き合うように結合~していました。このような荷電アミノ酸の近接構造によって、イオン結合部位はもはやH+を保持していることが出来なくなり、たとえpH 1もの強酸性の溶媒(胃酸)であってもH+の放出が可能になると考えられます。この仕組みは、ちょうどビリヤードの玉(H+)がキュー(リジン)ではじき出されるように、グルタミン酸からH+が1つだけ胃の中へとはじき出されることを想起させます(図5右)。
このリジンは、カエルからヒトまですべての胃プロトンポンプで共通するアミノ酸ですが、近縁のイオンポンプであるナトリウムポンプやカルシウムポンプでは、ちょうどこの位置にあるアミノ酸が、リジンからセリンへと置き換わっています。このようなイオン結合サイトのアミノ酸の違いや構造の違いによって、胃プロトンポンプは、他のイオンポンプでは達成できない強い酸性環境を胃の内部に作り出すことができるという仕組みが、今回の構造解析によって初めて明らかになりました。
謝辞
本研究は科学研究費補助金・基盤研究(B)(課題番号 17H03653)、基盤研究(S)(課題番号 22227004)、JST-CREST(JPMJCR14M4)、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)ならびに経済産業省(新エネルギー・産業技術総合開発機構(NEDO)、AMED次世代治療・診断実現のための創薬基盤技術開発事業「天然化合物及びITを活用した革新的医薬品創出技術」)の支援のもとで行われたものです。
【お問い合わせ先】 (AMED事業) (報道対応) 国立研究開発法人日本医療研究開発機構(AMED) (SPring-8 / SACLAに関すること) |
- 現在の記事
- 胃酸分泌を担う胃プロトンポンプの構造を解明 ~胃酸抑制剤結合構造と強酸に対してプロトンを吐き出す仕組み~(プレスリリース)




 cespi.nagoya-u.ac.jp
cespi.nagoya-u.ac.jp