エビの養殖に打撃を与えるエビノダウイルス(PvNV,MrNV)の原子構造を解明(プレスリリース)
- 公開日
- 2019年02月22日
- BL44XU(生体超分子複合体構造解析)
2019年2月22日
National Synchrotron Radiation Research Center, Taiwan
大阪大学 蛋白質研究所
発表のポイント
• エビの養殖業に打撃を与えるエビノダウイルスの原子構造を世界で初めて決定しました。
• エビノダウイルスの粒子全体の構造よりウイルス粒子の形成のしくみが得られ、宿主への感染に関わる突起部分の詳細構造が得られました。
• X線構造解析法とクライオ電子顕微鏡による手法を相補的に利用した成果です。
National Synchrotron Radiation Research Center(以下、NSRRC)のNai-Chi Chen博士研究員, Chun-Jung Chen 研究員, 吉村政人 助研究員、大阪大学蛋白質研究所の宮崎直幸助教、岩崎憲治招へい教授、中川敦史教授らの共同研究グループは, 養殖エビに感染し全滅に至らしめる原因ウイルス(PvNVおよびMrNV)のウイルス様粒子注1)の構造を大型放射光施設SPring-8のBL44XUおよび NSRRCの台湾放射光施設Taiwan Photon Source注2), Taiwan Light Source注2)を用いたX線結晶構造解析と、大阪大学蛋白質研究所のクライオ電子顕微鏡による解析により世界で初めて決定しました。 本研究成果は2019年2月20日に英国科学誌Communications Biologyに掲載されました。 論文情報 |
研究の背景
バナメイエビ(P. vannamei)とテナガエビ(M. rosenbergii)はエビの養殖業で経済的に重要度の高いエビの種類です。台湾、日本をはじめ世界各地でこれらのエビの養殖が行われています。これらのエビの養殖において問題の一つとなるのがP. vannamei nodavirus (PvNV)およびM. rosenbergii nodavirus (MrNV)の二つのエビノダウイルスで、それぞれのエビがこれらのウイルスに感染すると尾や筋肉が白くなる症状が出て死に至ります。養殖の場合、孵化や稚エビの段階で感染して全滅してしまうリスクがあります。これらのエビノダウイルスは、ノダウイルス科に属しています。ノダウイルス科には主に昆虫に感染するアルファノダウイルスと主に魚に感染するベータノダウイルスがあります。アルファノダウイルスとベータノダウイルスは既に原子構造が得られていますが、エビノダウイルスは原子構造が未知のままでした。
研究の成果と展望
研究グループは、PvNVウイルスのT=3注4)ウイルス様粒子, T=1注4)ウイルス様粒子のクライオ電子顕微鏡による手法で原子構造を決定し、PvNVおよびMrNVのウイルスの突起にあたる突起ドメインの1.3Å(1Åは1/1000万ミリメートル)の高分解能の構造をX線結晶構造解析により決定しました。またPvNVの突起ドメインを欠損した殻ドメインのみのT=1ウイルス様粒子の構造をX線結晶構造解析により決定しました。
PvNV T=3ウイルス様粒子は図1にあるように、カプシド蛋白質180個で構成され90個の突起がありました。それぞれの突起は隣り合う二つのカプシド蛋白質の突起ドメインが組み合わされた二量体でした。カプシド蛋白質の配置が異なる突起ドメインによる二量体で二種類の突起が一つの粒子内にあることが分かりました。
図1 PvNV ウイルス様粒子の全体図
左側がT=3粒子で右側がT=1粒子。T=3粒子で突起が90個ある。二つの粒子像はクライオ電子顕微鏡解析による。
図2はPvNV T=3のカプシド蛋白質の原子構造で, 3つのサブユニット(A,B,C)に分かれていました 。C末側注5)から突起ドメイン(P-domain C)で他分子と二量体を形成し突起を作っています。次はリンカーで粒子と突起とを繋ぎ二種類の突起の形成方法を可能とする柔軟性を保持しています。 次は殻ドメイン(S-domain C)で正二十面体粒子の形成を担っています。次はN-armドメインで粒子のT=3粒子の形成を補助しています。最後のN末端注5)のN-ARMドメインは観測では電子密度が薄く拡がっているのとN-ARMドメインが欠損するとT=3粒子がT=1粒子のみになることなどからT=3粒子の形成に重要な役割を担っていると予想されます。
図2 PvNVのカプシド蛋白質の構造
C末端から, 順に突起ドメイン(P-domain),リンカー, 殻ドメイン(S-domain), N-armドメイン、N-ARMドメインから構成される。T=3粒子を形成するときには、3つのカプシド蛋白質のうち二つが左側のサブユニットAとB、残り一つは右側のサブユニットCの三分子で一つのユニットを形成する。
図3にはPvNVとMrNVのそれぞれの突起ドメインの構造を比較した図で、エビの種類による感染の仕方の違いを詳しく調べることが可能になります。感染の仕方を詳細に研究することにより有効なワクチン開発につながると考えられます。
図3 PvNV(左)とMrNV(右)の突起ドメインの構造の比較
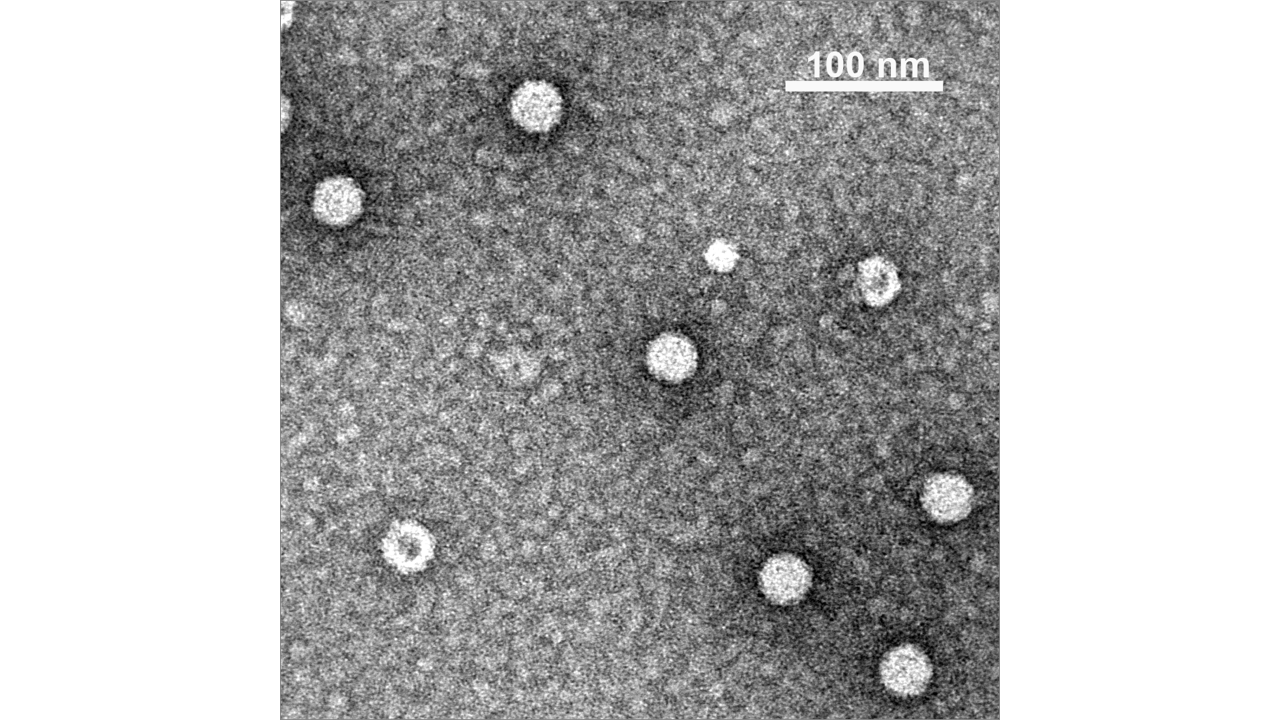
図4は、クライオ電子顕微鏡によるPvNVウイルス様粒子の写真で、大きなT=3粒子(直径約35nm)とより小さいT=1粒子が同時に観測されています。
結晶化が可能な場合、高精度(高分解能)で原子位置を決定することが出来ますが、これらのウイルス粒子のような大きな超分子複合体は、結晶化が困難あるいは結晶化できても非常に分解能が悪い場合が多くあります。その場合、クライオ電子顕微鏡による解析手法が有効となることが多く示されていてこの研究もその一つとなります。
図4 クライオ電子顕微鏡によるPvNVウイルス様粒子の写真
<用語説明>
[1] ウイルス様粒子
ウイルスはカプシドという蛋白質で構成した殻の中に遺伝子を収めているが、ウイルス様粒子はカプシドのみで遺伝情報を持たない粒子である。遺伝情報を持たないため、感染・増殖はしない。
[2] Taiwan Photon Source(TPS), Taiwan Light Source(TLS)
台湾National Synchrotron Radiation Research Centerの放射光施設で第3世代の放射光リング。 TPSは電子エネルギーが3GeVで2016年より稼働している。TLSは電子エネルギーが1.5GeVで台湾初の放射光リングで1993年より稼働している。
[3] ドメイン
蛋白質の配列、構造の一部でそれぞれ独立に進化し機能を持っている。ドメインはコンパクトな立体構造で独自に織り込むものとされている。
[4] T数
ウイルス粒子の形成する正二十面体の最小構成要素内に入るサブユニット(分子)の数。最小はT=1で60個のサブユニットで正二十面体粒子を形成する。次に小さいのはT=3で180個のサブユニットで正二十面体を形成する。
[5] C末端, N末端
蛋白質のアミノ酸配列の順序で、慣例的にN末端から始まりC末端で終わる。Nはアミノ基の窒素(N)、Cはカルボキシ基の炭素(C)からきている。
お問い合わせ先: Chun-Jung Chen (SPring-8 / SACLAに関すること) |
- 現在の記事
- エビの養殖に打撃を与えるエビノダウイルス(PvNV,MrNV)の原子構造を解明(プレスリリース)



 spring8.or.jp
spring8.or.jp