タンパク質結晶に分子を閉じ込め反応過程を可視化 -X線自由電子レーザーと量子化学計算による高精度解析-(プレスリリース)
- 公開日
- 2024年07月08日
- SACLA
2024年7月8日
東京工業大学
東北大学
筑波大学
理化学研究所
○化学反応中の分子の構造変化をリアルタイムかつ原子レベルで追跡することに成功。
○タンパク質結晶の中に、反応が起こる「場」を作り出し、溶液中のような状態を再現。
○さまざまな化合物が引き起こす化学反応を可視化し、新しい分子の機能を設計するための開発ツールとして期待。
|
東京工業大学 生命理工学院 生命理工学系のマイティ・バスデブ特任助教と上野隆史教授(兼 同 科学技術創成研究院 自律システム材料学研究センター)のグループは、東北大学 多元物質科学研究所の南後恵理子教授(兼 理化学研究所 放射光科学研究センター チームリーダー)、筑波大学 計算科学研究センターの庄司光男教授らの研究グループと共同で、化学反応性を持つ金属錯体※1をタンパク質結晶※2に固定化し、X線自由電子レーザー(XFEL)※3と量子古典混合(QM/MM)計算※4を用いて化学反応中の金属錯体の構造変化をナノ秒レベルで原子分解能追跡し、反応機構を解明する技術を開発した。 |
化学反応において短寿命の中間構造を決定することは、その反応メカニズムの理解が重要である。しかしながら、分光学的手法によって過渡的な活性種の形成を検出する手法はあるものの、その中間構造を決定し原子レベルで構造変化を追跡することは困難であった。一方で、近年、X線自由電子レーザー(XFEL)による時分割連続フェムト秒結晶構造解析(TR-SFX)法※7を用いた三次元立体構造解析によって、タンパク質の構造変化をコマ送り動画のように捉える技術が開発されつつある。この手法は、これまで天然のタンパク質や酵素の構造変化の観察に適用されることが多く、合成金属錯体などの低分子化合物によって促進される化学反応への応用は困難であった。その理由は、低分子化合物の場合、反応の際に大きな構造変化が起こりにくいこと、また構造データが得られにくいためである。そこで、研究グループは、タンパク質結晶を合成金属錯体の反応場として用いることにより、化学反応による合成金属錯体の構造変化を追跡できると考え、タンパク質結晶内に固定化した金属錯体の光励起反応の中間構造をTR-SFX法で決定することにより、反応過程の構造変化の直接観察を試みた(図1)。
図1. リゾチームの結晶構造と本研究の概略図
●研究成果
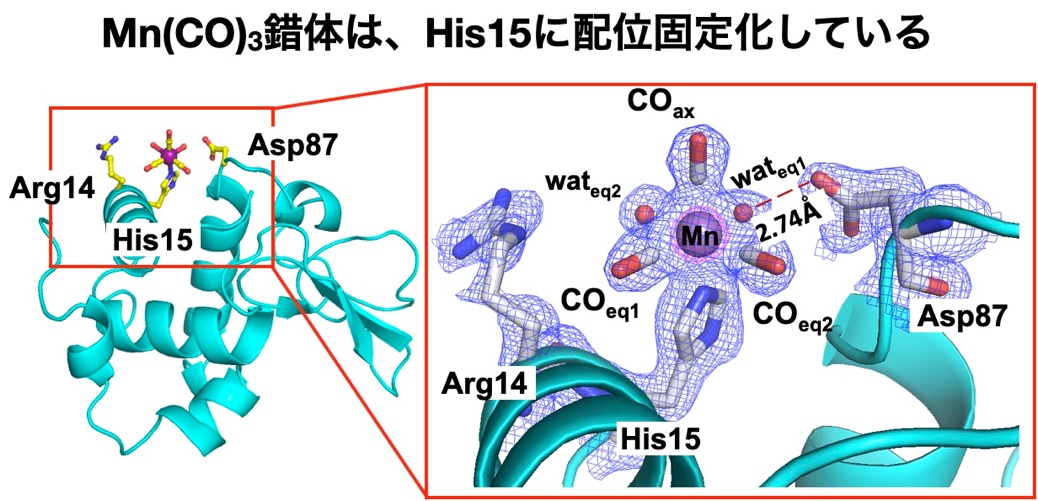
本研究グループは、光照射により一酸化炭素(CO)を放出するマンガンカルボニル(Mn(CO)3)錯体を多孔性のニワトリ卵白リゾチーム(HEWL)結晶に固定化し、CO放出反応中の金属錯体の構造変化をTR-SFX 法によって直接リアルタイムで観察することに成功した。 光照射による反応が結晶内で均一に起こることや、効率よくXFEL測定を行うことを考慮すると、長時間測定のためにサイズが20 μm未満の微結晶が大量に必要となる。本構造解析では、5-10 μmサイズのリゾチーム正方晶結晶を鋳型結晶とし、合成した結晶をMn(CO)3錯体溶液に浸漬させることでMn(CO)3とHEWLの複合体を調製することを検討した。正方晶はバルクスケールで10分以内に結晶を大量に合成することができ、内部に2.2 nmの細孔空間が存在する。合成したMn(CO)3-HEWL複合体のX線構造解析の結果、Mn(CO)3錯体は細孔表面に位置するアミノ酸His15に配位固定化していることが分かった(図2)。
図2. Mn(CO)3-HEWL複合体の結晶構造
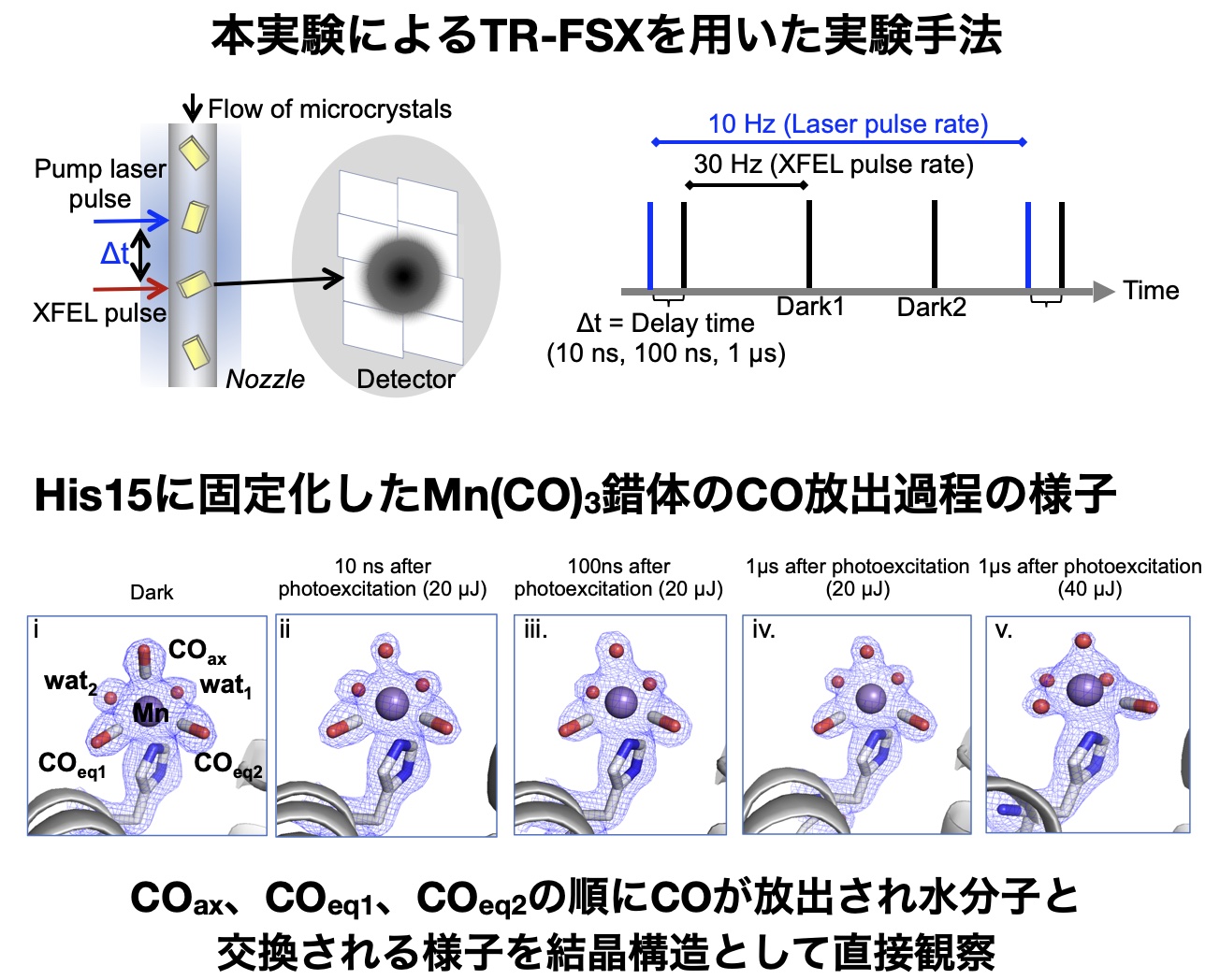
次に、Mn錯体の光励起化学反応の構造変化を直接観察するため、X線自由電子レーザー(XFEL)施設SACLA※8でナノ秒ポンプレーザーを用い、365 nmの紫外光を結晶に照射し、Mn(CO)3錯体からCOを放出させた。光を照射後、10ナノ秒から1マイクロ秒後にXFELによる回折実験を行い、コマ送り撮影のようにMn(CO)3錯体からCOが放出される過程の中間構造を観察した。Mn(CO)3錯体は、光照射前はリゾチーム結晶内で3つのCOリガンドと2つの水分子が配位し、八面体の配位構造を有している(図2)。光照射中の一連の構造解析の結果、アキシャル位のCO配位子が最初に放出され、Mnビスカルボニル種が中間体として観察された。その後、エカトリアル(eq1)に位置するCO配位子が放出され、最終的には、3つのCOが放出され、Mn錯体も放出された。さらに、反応中に起こるタンパク質の側鎖の関与とその構造変化についても可視化することができた(図3)。 実験的に観測されたMn錯体のCO放出の詳細を明らかにするために、量子古典混合(QM/MM)計算を行った。光照射前のリゾチーム結晶内のMn(CO)3(H2O)2の構造を用いてQM/MMモデルを構築したところ、Mnに配位している3つのCOの周辺にリゾチームのアミノ酸残基があることで、COと水分子の交換反応が配位位置によって変わり、選択的反応が起きることを明らかにした。さらに、TR-SFX法で直接観測した構造が主反応経路上にあることを示した。
図3. リゾチーム結晶に固定化したMn(CO)3錯体のCO放出過程の直接観察
●今後の展開
化学反応における低分子化合物の構造変化追跡のために、安定なタンパク質結晶の細孔空間を利用した本研究チームのアプローチは、低分子化合物による活性中心の構造ダイナミクスを実時間・実空間・原子レベルで可視化することができる。今後は、この手法を用いることで、光照射による化学反応だけでなく、金属触媒をタンパク質結晶に固定化した人工金属酵素内部で駆動する触媒反応の中間体構造の追跡など、より複雑な反応過程の直接観察へとつながり、触媒開発や医薬品設計など広範囲な応用が期待できる。
●社会的インパクト
化学反応を高速で追跡する手法は、これまでも開発されてきたが、原子レベルの分解能では達成されてこなかった。原子レベルでの反応過程の追跡のためには立体構造解析が必要不可欠だが、合成化合物の構造変化を直接観察することは困難であった。本研究は、高い結晶性を有するタンパク質結晶に金属錯体を固定化することで、金属錯体の化学反応過程を立体構造変化として観察することに成功した。本手法は、合成化合物による触媒反応から、クラスター形成、超分子反応まで、これまでの方法では不可能とされてきた化学反応追跡も実現できることから大きな社会的インパクトを持つと言える。
●付記
本成果は、文部科学省 科学研究費助成事業(JP19H05781、JP19H05776、JP23H04879、JP20H05438、JP22H04744、JP23K04928、JP18H05421、JP22H00347)、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)(JP21am0101070)、JST 戦略的創造研究推進事業CREST(JPMJCR20B3)の支援によるものである。
【用語解説】
※1. 金属錯体
金属イオンが有機分子と結合した構造を持つ化合物。
※2. タンパク質結晶
タンパク質分子が規則正しく3次元に配列した固体の集合体。タンパク質結晶のX線回折の強度を解析することにより、タンパク質の3次元立体構造を決定することができる。
※3. X線自由電子レーザー(XFEL)
X線領域の波長を持つレーザーであり、フェムト秒(1,000兆分の1秒)レベルの非常に短いパルス幅を持つ。XFELはX-ray Free Electron Laserの略。
※4. 量子古典混合(QM/MM)計算
化学反応が起こる領域は精度の高い量子力学(QM)計算で扱い、それ以外の部分は分子力学(MM)計算を適用する計算手法。
※5. 人工分子反応
人工合成分子によって設計された化学反応、生体内では不可能な化学反応を行うことができる。
※6. リゾチーム結晶
加水分解酵素であるリゾチームが3次元に集積した結晶状集合体。結晶化条件により、正方晶、斜方晶、単斜晶など異なる空間群の結晶をつくりわけ、微小結晶を大量に合成することができる。
※7. 時分割連続フェムト秒結晶構造解析(TR-SFX)法
結晶中の分子の微細な動きを高い時間分解能で観察する手法。構造変化を引き起こすレーザー光を結晶に与え、一定の遅延時間でX線自由レーザーによる測定を行うことで、結晶内のタンパク質構造変化を追跡できる。TR-SFXは、Time-Resolved Serial Femtosecond X-ray crystallographyの略。
※8. X線自由電子レーザー(XFEL)施設SACLA
理化学研究所と高輝度光科学研究センターが共同で建設した日本のXFEL施設。SACLA(サクラ)は、SPring-8 Angstrom Compact free electron LAserに由来する施設の愛称。SPring-8の10億倍明るいX線を、10フェムト秒未満のパルス時間内で提供する。照射時間が短いため、試料の損傷によるタンパク質の構造変化が起こる前に回折像を撮影することができる。
|
本件に関するお問い合わせ先 |
- 現在の記事
- タンパク質結晶に分子を閉じ込め反応過程を可視化 -X線自由電子レーザーと量子化学計算による高精度解析-(プレスリリース)