触媒サイクル中の酵素における基質の動きをSACLAで解明 ~基質がクルっと回転して反応する~(プレスリリース)
- 公開日
- 2025年03月12日
- SACLA
2025年3月12日
兵庫県立大学
理化学研究所
名古屋大学
|
兵庫県立大学大学院理学研究科の長尾聡特任助教(現 高輝度光科学研究センター)及び久保稔教授、理化学研究所放射光科学研究センターの當舎武彦専任研究員(現 兵庫県立大学)及び杉本宏専任研究員のグループは、名古屋大学大学院理学研究科の荘司長三教授らの研究グループと共同で、X線自由電子レーザー(XFEL)※1施設SACLA※2を活用し、触媒サイクル中、酵素内で基質※3の向きが精密に制御されることで、触媒反応が効率よく進む瞬間を捉えました。 |
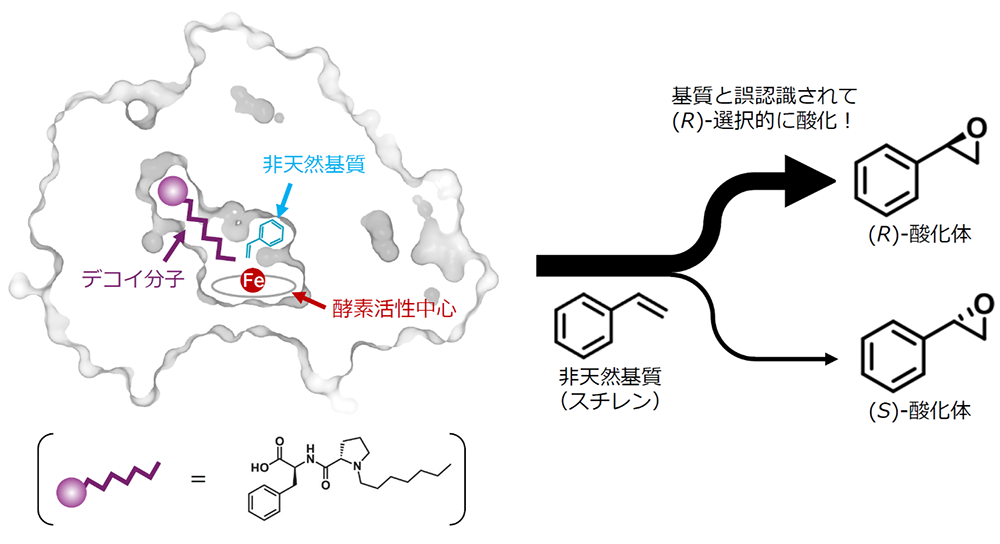
シトクロムP450は、鉄原子を巧みに利用してさまざまな基質の酸化反応を触媒する酵素であり、ステロイドホルモンや胆汁酸の生合成、薬物の代謝など、多くの重要な生物学的プロセスに関与しています。その中でも、長鎖脂肪酸の酸化反応を担うP450BM3は、シトクロムP450ファミリーの中でも顕著に高い活性を持つため、バイオ触媒開発において魅力的な出発点とされています。これまで、P450BM3を改変し、本来の基質でない化合物(非天然基質)を酸化させるためのタンパク質工学的試みが数多く行われてきました。その中で、共同研究グループの荘司教授らは基質誤認識システムを開発し、非天然基質であるスチレンを立体選択的に酸化させることに成功していました(図1)。しかし、P450BM3が非天然基質を酸化する仕組みは未解明でした。反応の仕組みを知るために、反応の途中で現れる「反応中間体」の構造を原子のレベルで観察することが長年望まれてきましたが、反応中間体は非常に不安定であるため、観察は困難でした。
図1.基質誤認識システムを利用した非天然基質の人工的酸化反応。酵素に基質と似た「デコイ分子」を結合させると、酵素はそれを基質と誤認して活性化し、本来の基質ではない化合物(非天然基質)を酸化できるようになる。図は、P450BM3にデコイ分子を結合させ、スチレンを立体選択的に酸化させた例を示している。
【研究内容と成果】
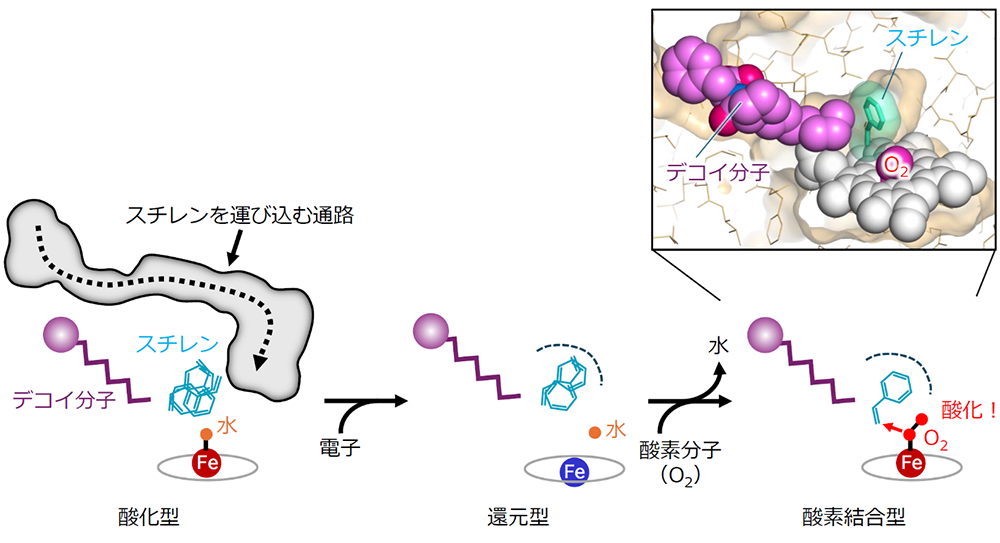
P450BM3は、以下の反応中間体を経て基質酸化を進めることが知られています(図2)。
① 酵素が不活性な状態(酸化型)
② 酵素が電子を受け取り、活性中心に存在する鉄原子を還元した状態(還元型)
③ 鉄原子に酸素分子(O2)が結合し、スチレンを酸化する準備に入った状態(酸素結合型)
本研究では、基質誤認識システムを用いたP450BM3に特定のアミノ酸を置換することで、反応中間体の安定性を向上させるとともに、スチレン酸化の活性と立体選択性に優れた人工P450BM3を作製しました。この人工P450BM3を用いて、①~③の反応中間体をフリーズトラップし、SACLAを用いた結晶構造解析により、それらの構造を明らかにしました。従来の放射光では、X線照射による反応中間体の崩壊が課題となっていましたが、SACLAが生成する極短パルスX線を用いることで、この課題を克服し、反応中間体が崩壊する前の一瞬の構造を捉えることに成功しました。
詳細な解析の結果、図2に示すように、最初の酸化型に結合したスチレンの向きは不安定でした。しかし、その後、鉄原子が還元され、酸素分子(O2)が鉄原子に結合する反応が進んでいくと、スチレンは特定の方向から酸化されやすいように「クルっと」回転して一つの向きに揃っていく機構が観測されました。また、スチレンを酵素活性中心へ運び込む通路も消失していました。これまでスチレンの位置や配向を制御する仕組みは不明でしたが、本研究により、鉄原子上で進行する精緻な化学反応が分子全体の構造を制御してスチレンとの反応を進めていることが明らかになりました。
図2. 触媒サイクルにおけるスチレンの配向制御機構。酵素活性中心に存在する鉄原子が電子を受け取って酸化型から還元型になると、スチレンを運び込む通路が閉じ、酵素内でスチレンは二通りの配向で安定化する。さらに鉄原子に酸素分子(O2)が結合して還元型から酸素結合型になると、スチレンはクルっと回転して、立体選択的に酸化されやすい配向に固定される。挿入図は、捉えることが非常に困難な酸素結合型の立体構造。
従来、シトクロムP450を基盤としたバイオ触媒開発は、不活性な酸化型の構造に基いて行われることが一般的でした。しかし、本研究で明らかにした反応中間体の構造は、酸化反応における基質の配置や酵素の立体構造が動的に制御されていることを示しています。本研究で発見したP450BM3の触媒サイクル中における基質の配向制御は、スチレン以外の基質や他のシトクロムP450の基質酸化においても存在する可能性があります。本研究で用いられた反応中間体のフリーズトラップとSACLAを組み合わせた構造解析の手法は、これらの反応機構を解明するための強力なツールになります。今後、この手法を活用することで、反応中間体の構造に基づいたバイオ触媒の設計が加速し、新たな触媒機能の創出に繋がることが期待されます。
【研究支援】本研究は、科学技術振興機構(JST)CREST(JPMJCR15P3)、日本学術振興会(JSPS)科学研究費(JP19H05784、JP24H02263、JP18KK0397、JP19K22403)による助成を受けて実施されました。
【発表者】
長尾 聡(兵庫県立大学大学院理学研究科 特任助教(研究当時)/現 高輝度光科学研究センター テニュアトラック研究員)
久保 稔(兵庫県立大学大学院理学研究科 教授)
當舎 武彦(理化学研究所放射光科学研究センター 専任研究員(研究当時)/現 兵庫県立大学大学院理学研究科 教授
杉本 宏(理化学研究所放射光科学研究センター 専任研究員)
荘司 長三(名古屋大学大学院理学研究科 教授)
【用語解説】
※1. X線自由電子レーザー(XFEL)
近年の加速器技術の発展によって実現したX線領域のパルスレーザー。SPring-8などの従来の放射光源と比較して、10億倍もの高輝度のX線がフェムト秒(1,000兆分の1秒)の時間幅を持つパルス光として出射される。この高い輝度を活かし、数十マイクロメートル以下の小さな結晶を用いたタンパク質の原子分解能の構造解析に利用されている。また、フェムト秒パルスの特性を活かし、X線照射による試料損傷が顕在化する前の構造を解析することが可能であり、鉄原子を含む酵素など、損傷が顕著な試料の構造解析に利用されている。
※2. SACLA
理化学研究所と高輝度光科学研究センターが共同で建設した日本ではじめてのXFEL施設。2011年3月に施設が完成し、SPring-8 Angstrom Compact free electron LAserの頭文字を取ってSACLAと命名された。大きさが諸外国の同様の施設と比べて数分の1とコンパクトであるにもかかわらず、0.1 nm以下という世界最短波長のレーザーの生成能力を持つ。高い空間コヒーレンス、短いパルス幅、高いピーク輝度を備えたX線領域のレーザーを発生させる。
※3. 基質
酵素に特異的に結合し、化学反応によって生成物へと変化される分子の総称。
※4. シトクロムP450BM3
巨大菌(Priestia megaterium)由来のシトクロムP450タンパク質。酸素分子(O2)を用いて長鎖脂肪酸を酸化する酵素で、報告されているシトクロムP450ファミリーの中で最も高い触媒活性をもつ。
※5. タンパク質工学
天然のタンパク質のアミノ酸配列を改変することで、有用な機能をもつ人工タンパク質を設計・開発する手法。
※6. 基質誤認識システム
本来の基質に似た分子(デコイ分子)をP450BM3に結合させると、P450BM3は基質を結合したと誤認識して活性化し、本来の基質ではないスチレンなどを酸化できるようになる。この仕組みを利用して非天然基質を酸化可能にしたバイオ触媒システム。
※7. フリーズトラップ
試料の状態が変化しないように、液体窒素などを用いて試料を急速に凍結する実験手法。本研究では、P450BM3反応中間体の微結晶を液体窒素で凍結し、−170℃以下に保ちながらSACLAで実験を行った。
|
本件に関するお問い合わせ先 |
- 現在の記事
- 触媒サイクル中の酵素における基質の動きをSACLAで解明 ~基質がクルっと回転して反応する~(プレスリリース)
 ofc.u-hyogo.ac.jp
ofc.u-hyogo.ac.jp